En cualquier laboratorio de autocontrol, esté o no en una norma de calidad, se preocupa uno más o menos de realizar los análisis lo mejor posible y sí sus consecuencias pueden ser graves, tipo resíduos en carne, con mayor razón. Sin embargo, todo ese trabajo se puede frustrar en una labor fuera de analíticas y del laboratorio, como es la toma de muestra.
Durante los quince años que he desarrollado mi labor, me han traído muestras de patología incorrectas, sanas o con resíduos de antibióticos para analizar el posible microorganismo causante
de la patología. Por causas ajenas a mí, el resultado sería incorrecto.En las muestras de agua clorada, es evidente que en la toma de muestra debes extremar el cuidado en quemar la boca de los grifos, pero,¿ y si la muestra te la envían sin un neutralizante del cloro como el tiosulfato sódico?. La muestra saldrá negativa aún cuando haya marcadores microbiológicos que indicarían que se deben aplicar medidas correctoras.
En muestreo microbiológico de canales, estas pueden salir dentro de los niveles marcados por la directiva europea, pero y sí las canales han sido tratadas con inhibidores o con ácido acético o láctico (este último creo quelo han autorizado para reducir la contaminación microbiana en determinadas zonas de la canal). En esta ocasión sí se puede saber, te lo indican las diluciones seriadas. Por ejemplo en 10-2 no tendrías crecimiento o sería bajo o nulo y mayor en la dilución 10-3 o sucesivas. La primera vez pensarías que te equivocaste, pero no cuando te ocurre en veces sucesivas.
Ha habido casos como el último de Salmonella en pollo, que al final todos intentan quitarse el problema y este recae sobre el laboratorio de autocontrol. En ese caso se había manipulado un proceso que hizo que se produjera la contaminación de la salsa y posterior del pollo, todo ello era ajeno a la labor del analista, que creo que finalmente acabó pagando el pato.
La toma de muestra debe ser realizada por personal cualificado o bien formado por el propio laboratorio y responsable, sin injerencias ni de dirección ni del SVO. Sí la toma es realizada por personal externo, adjunto al Servicio veterinario oficial o los mismos SVO, este trabajo dependerá totalmente de la actitud y aptitud de aquellos y no de la eficiencia o ineficiencia (de todo habrá) del laboratorio y su(s) analistas.
Finalmente, tanto sí el laboratorio está o no en una ISO, 17025, 15185, o la que sea, lo que interesa es hacer intercomparaciones externas de los distintos procesos, para tener una prueba fehaciente frente a terceros de que nuestro trabajo está bien realizado. Nosotros realizamos intercomparaciones de análisis vía húmeda de piensos, microbiología en distintas matrices y microorganismos y de residuos.
Tras 15 años de experiencia en un laboratorio de autocontrol para un grupo cárnico, Grupo Cárnico Los González, puedo compartir con mi experiencia. Desde patología animal hasta el análisis de agua y canales en matadero,toma de muestras, análisis microbiológicos y controles de residuos en carnes. Experience in a laboratory , from animal pathology until water testing and slaughter channels, sampling, analysis and microbiological monitoring residues in meat . Benito Herraiz, Biólogo
lunes, 29 de abril de 2013
miércoles, 24 de abril de 2013
FOTOS BRANHAMELLA CATARRHALIS Y GÉNERO MORAXELLA
BRANHAMELLA OVIS: Implicada en procesos oculares de ovíno junto a Mycoplasma y clamidias.
BRANHAMELLA CATARRHALIS: Diplococos ("granos de café"), Gram negativos, oxidasa y catalasa positivos. Identificación por API 20NE. Muestra de pulmón.
MORAXELLA SP.: Bacilos gram negativos gruesos, a veces unidos lateralmente. También oxidasa positiva y catalasa muy positiva.Implicada en infecciones oculares.
jueves, 18 de abril de 2013
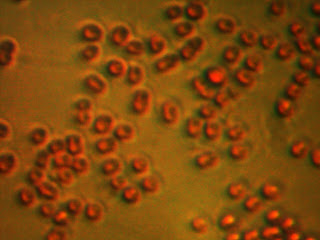
FOTOS DE GÉNERO SALMONELLA EN MEDIO SMS.
Para el autocontrol microbiológico de canales utilizabamos un medio semisólido, SMS de AES, al principio tenía baja caducidad y venía en placas, lo cual resultaba poco útil para el trabajo en laboratorio. Posteriormente , se pudo usar reconstituyendo botellas con una caducidad mucho mas amplia y preparando las placas en el momento del uso. Es un método con ventajas de tiempo claras con respecto al método oficial, el cual te vas a tres o cuatro días en caso de negativos.Es un protocolo validado como exige la norma, MÉTODO VALIDADO AFNOR (PROTOCOLOS:
aes 10 / 04-05 / 04 ). En este son dos días, uno de preenrriquecimiento y otro de lectura. Es un método avalado por una certificación como marca la norma, básicamente consiste en aprovechar la movilidad de las cepas de Salmonella (99% y todas las patógenas para el hombre), junto con un viraje en caso positivo de verde esmeralda a rojo y la opacidad del medio. Se siembran tres puntos de la placa petri con 0.1ml de caldo ya incubado, incubar 24 horas a 42ºC y lectura al día siguiente. Los casos e posibles positivos resembrar en medio como MacConkey y realizar aglutinación por latex. Sí es positiva puede hacerse identificación por ID32e o API 20E. Os adjunto fotos.
NEGATIVA: Existe viraje, movilidad reducida y no opacidad.
POSITIVAS: Viraje, amplia movilidad y placa opaca o turbia.

NEGATIVA: Existe viraje, movilidad reducida y no opacidad.

lunes, 15 de abril de 2013
MUESTREO MICROBIOLÓGICO DE CANALES POR MÉTODO DESTRUCTIVO:
MATERIAL:
- 5 Tubos con filo y estériles de 13 mm de diámetro ( aprox. 5
cm2), usando uno para cada canal (total 5 canales).
- Agua de peptona tamponada (BPW)
- Escarpelos estériles.
- Contenedores de orina estériles.
- Petrifilms: Petrifilm
de enterobacterias (EB).
Petrifilm
de recuento de aerobios en placa (AC).
MUESTREO:
5 Canales semanales de cordero y 5 canales semanales de
ternera. Opcionalmente canales de oveja según SVO.
PROTOCOLO:
1º Toma de muestras, por personal cualificado, de 5 canales
de cordero o de ovino mayor y 5 canales
de bovino, cada semana. Tomando 4 muestras por canal de las zonas determinadas
por la Normativa
2001/471/CE.
2º Traslado inmediato
al laboratorio para su procesado. El tratamiento de la muestra se
realizará dentro de las 24 horas después de la toma de muestras.
3º Cada contenedor de orina, corresponderá con una canal y
contendrá las 4 tomas realizadas de la canal (5 contenedores por cada
muestreo). Se le añaden 100 ml de agua de peptona tamponada o de la solución salina (según directiva).
4º Introducir en una bolsa de stomacher y homogeneizar en
Masticator durante, al menos, 2 minutos. Generándose así, la solución madre (100).
5º Realizar diluciones decimales hasta 1010 o
hasta donde la experiencia indique probabilidad de crecimiento.
6º Coger 1 ml de 10-1, 10-2, etc. y
echarlo en petrifilm de EB y AC. Normalmente se realiza 100, 10-1
y 10-2 de EB y 10-1, 10-2 y 10-3 de
AC.
7º Incubar a 35º C 24 horas para EB y 48 horas para AC.
DECISIÓN 2001/471/CE
|
VALORES ACEPTABLES
(M)
|
VALORES DUDOSOS
(> m pero ≤ M)
|
VALORES INACEPTABLES
(> M)
|
Ovinos / Bovinos
|
Ovinos / Bovinos
|
Ovinos / Bovinos
|
|
Recuento
total de colonias aerobias (TVC)
|
< 3160
|
> 3160 pero ≤ 105
|
> 105
|
Enterobacterias
|
< 31.6
|
> 31.6 pero ≤ 316
|
> 316
|
- 0,5 LOG = 0.316 UFC/CM2
ÚLTIMA MODIFICACIÓN ENERO – 2006
NORMATIVA APLICABLE: REGLAMENTO 2073/2005
REGLAMENTO 1441/2007
REGLAMENTO 1086/2011
Las revisaremos en otra entrada.
domingo, 14 de abril de 2013
miércoles, 10 de abril de 2013
martes, 9 de abril de 2013
BACTERIA GÉNERO CLOSTRIDIUM, video
Este vídeo es de los primeros que realicé, está basado en la incorporación a microscopio Kiowa , un microscopio digital Ednet de 100 aumentos, hay fallo en la luz que se ve roja. Esto luego se subsanó utilizando una fuente de luz independiente. Cuando localice los otros vídeos, los iré poniendo ya que son de más calidad.
lunes, 8 de abril de 2013
LABORATORIO DE AUTOCONTROL
El laboratorio en el que trabajé era un edificio ya construido aprovechado por la empresa para la ubicación del laboratorio. Por ello hubo que hacer una serie de modificaciones como fueron instalar un a ventilación general y programada, con una serie de conducciones y un electroventilador con temporizador. Así mismo se tuvo que instalar una campana de extracción de gases para los productos más problemáticos. Se climatizó todo el laboratorio con bombas de calor y se refrigeró la sala de medicamentos y vacunas. No se pudieron subsanar fallos como las ventanas y la anchura de puertas.Posteriormente se realizó una sala blanca y en ella si se pudieron establecer sistemas de filtración de aire y de trabajo a baja presión.Os adjunto el esquema general por si os interesa.
jueves, 4 de abril de 2013
CLASIFICAR BACTERIAS EN LABORATORIO.
A partir de distintas muestras, sea de patología animal o de agua, podemos aislar una cepa bacteriana en concreto, que proviene de una sola colonia, la cual en teoría puede provenir de una sola bacteria. Este aislamiento lo explicaremos en otra ocasión. A partir de un cultivo que ya consideraremos "puro", hay que realizar una serie de pasos para poner nombre (género) y primer apellido(especie) a la cepa que tenemos.
Empezaremos por hacer una tinción que discrimine entre dos grandes grupos, GRAM+ Y GRAM -, la tinció de GRAM.
No nos valdrás para grupo de mycobacterias ni micoplasmas, pero como son complicados de cultivar, tendremos un amplio espeectro de las bacterias cubierto.
Lo siguiente sería diferenciaciones enzimáticas, como grupo oxidasa + o -.Es decir dividiriamos aún más el grupo al que pertenece, por ejemplo: G-,Ox+.
Como tercerpaso preliminar haríamos la prueba de la catalasa, catalasa positiva o negativa. Con estas tres pruebas, unidas a las de microscopía( forma, tamaño) y otras como la hemólisis, podremos pasar a sistemas bioquímicos como API (20NE, ID32E, 20E...).Sí la bacteria está en la base de datos, ya la tendremos identificada, sí su porcentaje es alto, mayor 90%. En el caso de clínica veterinaria , por ejemplo la antigua Pasteurella trehalosi, ahora B.trehalosi o Branhamella ovis, será necesaria hacer comparaciones con PCR.
Os adjunto fotos:
GRAM+ GRAM-
Empezaremos por hacer una tinción que discrimine entre dos grandes grupos, GRAM+ Y GRAM -, la tinció de GRAM.
No nos valdrás para grupo de mycobacterias ni micoplasmas, pero como son complicados de cultivar, tendremos un amplio espeectro de las bacterias cubierto.
Lo siguiente sería diferenciaciones enzimáticas, como grupo oxidasa + o -.Es decir dividiriamos aún más el grupo al que pertenece, por ejemplo: G-,Ox+.
Como tercerpaso preliminar haríamos la prueba de la catalasa, catalasa positiva o negativa. Con estas tres pruebas, unidas a las de microscopía( forma, tamaño) y otras como la hemólisis, podremos pasar a sistemas bioquímicos como API (20NE, ID32E, 20E...).Sí la bacteria está en la base de datos, ya la tendremos identificada, sí su porcentaje es alto, mayor 90%. En el caso de clínica veterinaria , por ejemplo la antigua Pasteurella trehalosi, ahora B.trehalosi o Branhamella ovis, será necesaria hacer comparaciones con PCR.
Os adjunto fotos:
GRAM+ GRAM-
NUEVA ANDADURA DE FOTOS MICRO.
El presente blog nació como una prueba para un taller de empleo de NNTT en Calamocha. Tras varios años paralizado por diferentes motivos, entre ellos el desarrollo de otros blog, como Calderas, generadores y biomasa, así como Paleontología del Jiloca, vuelvo a él para mostraros las experiencias adquiridas y fotos creo que muy interesantes.
Suscribirse a:
Comentarios (Atom)